Сравнение пробирок для стабилизации внеклеточной ДНК Streck Cell-Free DNA BCT и Roche Cell-Free DNA Collection Tubes
Обзор основан на публикации: Sarah Parackal, Donghui Zou, Robert Day, Michael Black, Parry Guilford, Practical Laboratory Medicine, 16 (2019)
В настоящее время клиническая практика наблюдения за онкологическими больными обычно включает рентгенологическое исследование. Эта процедура имеет существенные недостатки, такие как облучение, неудобства для пациента и высокие эксплуатационные расходы.
Наличие циркулирующих в кровеносном русле нуклеиновых кислот позволяет преодолеть эти ключевые недостатки. В настоящее время разрабатываются методы наблюдения за онкологическим процессом, основанные на исследовании внеклеточной ДНК (cfDNA, вкДНК), циркулирующей в кровотоке.
Феномен циркулирующей внеклеточной ДНК хорошо известен и достаточно изучен:
• вкДНК представляет собой короткие фрагменты клеточной ДНК (размер 130-180 п.н.), попадающие в кровоток через апоптоз, некроз и активную секрецию;
• вкДНК характерна для более чем 90% здоровых индивидуумов;
• количество вкДНК существенно возрастает при воспалении, повреждении тканей, физической нагрузке, беременности и т.д.
Обзор основан на публикации: Sarah Parackal, Donghui Zou, Robert Day, Michael Black, Parry Guilford, Practical Laboratory Medicine, 16 (2019)
В настоящее время клиническая практика наблюдения за онкологическими больными обычно включает рентгенологическое исследование. Эта процедура имеет существенные недостатки, такие как облучение, неудобства для пациента и высокие эксплуатационные расходы.
Наличие циркулирующих в кровеносном русле нуклеиновых кислот позволяет преодолеть эти ключевые недостатки. В настоящее время разрабатываются методы наблюдения за онкологическим процессом, основанные на исследовании внеклеточной ДНК (cfDNA, вкДНК), циркулирующей в кровотоке.
Феномен циркулирующей внеклеточной ДНК хорошо известен и достаточно изучен:
• вкДНК представляет собой короткие фрагменты клеточной ДНК (размер 130-180 п.н.), попадающие в кровоток через апоптоз, некроз и активную секрецию;
• вкДНК характерна для более чем 90% здоровых индивидуумов;
• количество вкДНК существенно возрастает при воспалении, повреждении тканей, физической нагрузке, беременности и т.д.
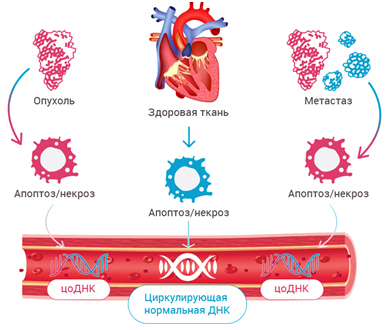
Апоптоз – генетически запрограммированная (физиологическая) гибель клеток, которая приводит к аккуратной «разборке» и удалению клеток
Некроз - повреждение клеточной мембраны химическими агентами или физическими факторами; поврежденные клетки лизируются; развивается воспалительный процесс
Фрагменты ДНК могут попадать в кровоток, как из нормальных клеток организма, так и опухолевых клеток. Циркулирующая опухолевая ДНК (ctDNA, цоДНК) - это внеклеточная ДНК, которую в кровоток выделяют клетки опухоли.
Некроз - повреждение клеточной мембраны химическими агентами или физическими факторами; поврежденные клетки лизируются; развивается воспалительный процесс
Фрагменты ДНК могут попадать в кровоток, как из нормальных клеток организма, так и опухолевых клеток. Циркулирующая опухолевая ДНК (ctDNA, цоДНК) - это внеклеточная ДНК, которую в кровоток выделяют клетки опухоли.
В настоящее время цоДНК разрабатывается в качестве клинического инструмента («жидкая биопсия») для диагностики и наблюдения за онкологическими заболеваниями, без необходимости физического проведения биопсии.
Получение цоДНК происходит посредством обычного взятия крови у пациента. Анализ состоит из обнаружения и количественного определения мутаций-маркеров с использованием таких методов, как целевое секвенирование следующего поколения (NGS) и методы цифровой ПЦР (ddPCR и BEAMing). Результаты такого анализа в реальном времени представляют молекулярную картину динамики онкологического процесса и реакции опухоли на лечение.
Получение цоДНК происходит посредством обычного взятия крови у пациента. Анализ состоит из обнаружения и количественного определения мутаций-маркеров с использованием таких методов, как целевое секвенирование следующего поколения (NGS) и методы цифровой ПЦР (ddPCR и BEAMing). Результаты такого анализа в реальном времени представляют молекулярную картину динамики онкологического процесса и реакции опухоли на лечение.
Многочисленные исследования продемонстрировали обоснованность использования циркулирующей опухолевой ДНК в клиническом диагностическом сценарии, однако ее применение затрудняется отсутствием стандартизированных операционных протоколов.
В частности, преаналитические переменные, такие как сбор образцов, длительность хранение и транспортировка на большие расстояния, оказывают существенное влияние на целостность циркулирующей ДНК и ее пригодность для последующего тестирования.
Регулярный анализ цоДНК требует, чтобы серийные образцы крови отбирались у пациентов в пробирки с антикоагулянтом, таким как этилендиаминтетрауксусная кислота калия (K3EDTA). Однако использование только антикоагулянта K3EDTA для стабилизации образцов крови является существенным препятствием для долговременного сохранения вкДНК после венепункции.
В выполненных ранее исследованиях было определено, что образцы крови, собранные в пробирки с K3EDTA, должны быть обработаны в течение 24 часов после венепункции, чтобы предотвратить лизис лейкоцитов и высвобождение в плазму геномной ДНК. Срок хранения образцов может быть увеличен за счет их охлаждения (4-6°C), но это значительно увеличивает стоимость доставки. Кроме того, отправка образцов в удаленные лаборатории происходит в условиях постоянного перемешивания и колебаний температуры, что, как известно, значительно увеличивают лизис лейкоцитов. K3EDTA категорически не подходит для длительного хранения образцов (> 24 ч) при комнатной температуре.
Следовательно, специальные пробирки, со стабилизатором внеклеточной ДНК, приобретают особое значение для точного выявления и количественного определения вкДНК в клинических исследованиях.
Коммерчески доступные пробирки для вкДНК соединяют в себе сбор, транспортировку и долгосрочное хранение образцов крови для последующего выделения и анализа вкДНК. Такие пробирки содержат консервационный буфер, который предназначен для стабилизации образца крови и предотвращения лизиса лейкоцитов при колебаниях температуры и перемешивании в течение длительного периода (более 10 дней).
Пробирка Cell-Free DNA BCT (Streck, США) содержит запатентованный буфер, стабилизирующий образцы цельной крови в процессе сбора, транспортировки и хранения, для последующего клинического анализа вкДНК. Образцы крови в пробирках Streck BCT стабильны в течение 14 дней после венепункции, в пределах температур 6-37°C. Обширные валидационные исследования пробирок Streck BCT, в сравнении со стандартными пробирками с K3EDTA, показали значительное снижение выхода геномной ДНК (gДНК) из лейкоцитов в плазму при различных условиях доставки образца. Существует коммерчески доступный похожий продукт - пробирки Roche Cell-Free Collection Tubes (Roche). Пробирки Roche также содержат стабилизирующий буфер, который, как утверждает производитель, предотвращает высвобождение gДНК в течение 7 дней после сбора в различных условиях поставки.
Чтобы выявить возможные различия в стабильности вкДНК между пробирками Streck Cell-Free DNA BCT и Roche Cell-Free Collection Tubes, был проведен ряд исследований. Сравнивались концентрации вкДНК и уровни ее загрязнения геномной ДНК при хранении пробирок с образцами в течение 14 дней с момента сбора при комнатной температуре (22°C). Был выбран 14-дневный период хранения, поскольку это максимальный период времени для поддержания стабильности образца, указанный производителем пробирок Streck BCT.
Архитектура исследования
Кровь (~ 8,5–10 мл) брали у здоровых добровольцев венепункцией в пробирки Streck Cell-Free DNA BCT и Roche Cell-Free Collection Tubes. У одного добровольца кровь была также взята в пробирки K3EDTA BD Vacutainer. Все образцы хранились при температуре 22°С.
Образцы обрабатывали в дни 0, 4, 7, 10 и 14 после сбора. В День 0 образцы обрабатывали в течение 2 часов после взятия крови. Плазму отделяли от эритроцитов центрифугированием. ДНК выделяли из плазмы с использованием набора QIAGEN для циркулирующей нуклеиновой кислоты.
В частности, преаналитические переменные, такие как сбор образцов, длительность хранение и транспортировка на большие расстояния, оказывают существенное влияние на целостность циркулирующей ДНК и ее пригодность для последующего тестирования.
Регулярный анализ цоДНК требует, чтобы серийные образцы крови отбирались у пациентов в пробирки с антикоагулянтом, таким как этилендиаминтетрауксусная кислота калия (K3EDTA). Однако использование только антикоагулянта K3EDTA для стабилизации образцов крови является существенным препятствием для долговременного сохранения вкДНК после венепункции.
В выполненных ранее исследованиях было определено, что образцы крови, собранные в пробирки с K3EDTA, должны быть обработаны в течение 24 часов после венепункции, чтобы предотвратить лизис лейкоцитов и высвобождение в плазму геномной ДНК. Срок хранения образцов может быть увеличен за счет их охлаждения (4-6°C), но это значительно увеличивает стоимость доставки. Кроме того, отправка образцов в удаленные лаборатории происходит в условиях постоянного перемешивания и колебаний температуры, что, как известно, значительно увеличивают лизис лейкоцитов. K3EDTA категорически не подходит для длительного хранения образцов (> 24 ч) при комнатной температуре.
Следовательно, специальные пробирки, со стабилизатором внеклеточной ДНК, приобретают особое значение для точного выявления и количественного определения вкДНК в клинических исследованиях.
Коммерчески доступные пробирки для вкДНК соединяют в себе сбор, транспортировку и долгосрочное хранение образцов крови для последующего выделения и анализа вкДНК. Такие пробирки содержат консервационный буфер, который предназначен для стабилизации образца крови и предотвращения лизиса лейкоцитов при колебаниях температуры и перемешивании в течение длительного периода (более 10 дней).
Пробирка Cell-Free DNA BCT (Streck, США) содержит запатентованный буфер, стабилизирующий образцы цельной крови в процессе сбора, транспортировки и хранения, для последующего клинического анализа вкДНК. Образцы крови в пробирках Streck BCT стабильны в течение 14 дней после венепункции, в пределах температур 6-37°C. Обширные валидационные исследования пробирок Streck BCT, в сравнении со стандартными пробирками с K3EDTA, показали значительное снижение выхода геномной ДНК (gДНК) из лейкоцитов в плазму при различных условиях доставки образца. Существует коммерчески доступный похожий продукт - пробирки Roche Cell-Free Collection Tubes (Roche). Пробирки Roche также содержат стабилизирующий буфер, который, как утверждает производитель, предотвращает высвобождение gДНК в течение 7 дней после сбора в различных условиях поставки.
Чтобы выявить возможные различия в стабильности вкДНК между пробирками Streck Cell-Free DNA BCT и Roche Cell-Free Collection Tubes, был проведен ряд исследований. Сравнивались концентрации вкДНК и уровни ее загрязнения геномной ДНК при хранении пробирок с образцами в течение 14 дней с момента сбора при комнатной температуре (22°C). Был выбран 14-дневный период хранения, поскольку это максимальный период времени для поддержания стабильности образца, указанный производителем пробирок Streck BCT.
Архитектура исследования
Кровь (~ 8,5–10 мл) брали у здоровых добровольцев венепункцией в пробирки Streck Cell-Free DNA BCT и Roche Cell-Free Collection Tubes. У одного добровольца кровь была также взята в пробирки K3EDTA BD Vacutainer. Все образцы хранились при температуре 22°С.
Образцы обрабатывали в дни 0, 4, 7, 10 и 14 после сбора. В День 0 образцы обрабатывали в течение 2 часов после взятия крови. Плазму отделяли от эритроцитов центрифугированием. ДНК выделяли из плазмы с использованием набора QIAGEN для циркулирующей нуклеиновой кислоты.
Концентрацию плазменной ДНК измеряли на флуориметре.
Разделение фрагментов ДНК по размерам выполняли с помощью капиллярного электрофореза.
Количественное определение фрагментов ДНК длиной 35 - 10380 п.н. проводили по электрофореграмме (флуоресцентные пики).
Это позволяло визуально различать вкДНК (длиной ~165 п.н.) и загрязнение геномной ДНК.
Для каждого субъекта были рассчитаны различия в концентрациях вкДНК (Streck минус Roche).
Стабилизация вкДНК в пробирках Streck и K3EDTA
Степень загрязнения образцов геномной ДНК в различные моменты времени выявляли с помощью капиллярного электрофореза. Размер фрагмента ДНК определяли по интенсивности флуоресценции (в единицах измерения FU). Большинство фрагментов вкДНК имеют длину приблизительно 165 п.н., тогда как gДНК состоит из более длинных высокомолекулярных фрагментов около 10 000 п.н. Таким образом, выявлялись образцы с загрязнением gДНК, возрастающим в течение пяти временных периодов.
Электрофореграммы для образцов День 0 и День 14, хранившихся в пробирках Streck и K3EDTA, показаны ниже. Графики дают визуальное представление об уровне вкДНК и начале ее загрязнения геномной ДНК. Пики ДНК количественно определяются между двумя маркерами: нижним (35 п. н.) и верхним (10 380 п. н.). Пик внеклеточной ДНК был идентифицирован между 150 и 200 п. н. Пики геномной ДНК сгруппированы вокруг верхнего маркера. Графики показаны для трех добровольцев.
1) Пробирки Streck
Электрофореграмма образца Streck в День 0 показывает пик вкДНК 182 п.н. при интенсивности флуоресценции 40 FU (А), два дополнительных пика 375 п.н. и 500 п.н. и фрагменты геномной ДНК от 4000 до 6000 п.н. при 10 FU. На 14-й день флуоресценция пика вкДНК снизилась до 20 FU (В), геномная ДНК вблизи верхнего маркера имела ту же интенсивность флуоресценции, что и в образце Дня 0. Очевидного лизиса лейкоцитов и массового выхода gДНК не наблюдалось.
2) Пробирки K3EDTA
В пробирке с K3EDTA определяли загрязнение внеклеточной ДНК в результате лизиса лейкоцитов в образцах, не содержащих клеточного стабилизатора. В образце K3EDTA День 0 был выявлен пик вкДНК 181 п.н. с флуоресценцией 18 FU и несколько фрагментов gДНК от 3000 до 8000 п.н. при <10 FU (E). На День 14 значительно увеличилось количество фрагментов ДНК и интенсивность их флуоресценции с наибольшим пиком 9000 п.н. при 2000 FU. Флуоресценция этих длинных фрагментов частично затеняет пик вкДНК (F).
В пробирке с K3EDTA определяли загрязнение внеклеточной ДНК в результате лизиса лейкоцитов в образцах, не содержащих клеточного стабилизатора. В образце K3EDTA День 0 был выявлен пик вкДНК 181 п.н. с флуоресценцией 18 FU и несколько фрагментов gДНК от 3000 до 8000 п.н. при <10 FU (E). На День 14 значительно увеличилось количество фрагментов ДНК и интенсивность их флуоресценции с наибольшим пиком 9000 п.н. при 2000 FU. Флуоресценция этих длинных фрагментов частично затеняет пик вкДНК (F).
Стабилизация вкДНК в пробирках Streck и Roche
Для образцов, собранных в пробирки Streck BCT, не наблюдалось статистически значимого изменения общей концентрации вкДНК между днями 0 – 4, 0 – 7, 0 – 10 и 0 – 14 (p > 0,05). Для образцов, хранящихся в пробирках Roche, средние концентрации вкДНК достоверно различались между днями 0 – 4, 0 – 7, 0 – 10 и 0 – 14 (p <0,05). Это свидетельствует о загрязнении геномной ДНК образцов Roche в результате лизиса лейкоцитов, начиная с 7-го дня хранения при комнатной температуре (Таблица 1).
Для образцов, собранных в пробирки Streck BCT, не наблюдалось статистически значимого изменения общей концентрации вкДНК между днями 0 – 4, 0 – 7, 0 – 10 и 0 – 14 (p > 0,05). Для образцов, хранящихся в пробирках Roche, средние концентрации вкДНК достоверно различались между днями 0 – 4, 0 – 7, 0 – 10 и 0 – 14 (p <0,05). Это свидетельствует о загрязнении геномной ДНК образцов Roche в результате лизиса лейкоцитов, начиная с 7-го дня хранения при комнатной температуре (Таблица 1).
В более ранних публикациях (Alidousty et al., 2017; Nikolaev et al., 2018) также оценивалось, как влияет продолжительность хранения цельной крови (при 22°С) на обнаружение геномной ДНК в пробирках для вкДНК Streck и Roche. Для этого в течение 7 дней с момента сбора образца определяли уровни загрязнения плазмы геномной ДНК. Статистически значимой разницы между пробирками Streck и Roche не было обнаружено.
Однако в образцах, хранившихся в пробирках Roche при колеблющихся температурах (22 - 30°С), gДНК обнаруживается, начиная с 5-го дня хранения. В пробирках Streck, при таком же режиме хранения, фрагменты геномной ДНК не выявлялись.
Однако в образцах, хранившихся в пробирках Roche при колеблющихся температурах (22 - 30°С), gДНК обнаруживается, начиная с 5-го дня хранения. В пробирках Streck, при таком же режиме хранения, фрагменты геномной ДНК не выявлялись.
Выводы:
1. Пробирки Streck BCT сохраняли стабильность образца крови в течение 14 дней после сбора, в отличие от пробирок Roche, которые стабилизировали образец только в течение 7 дней. Это согласуется с рекомендациями производителей Streck и Roche, а также с предыдущими исследованиями.
2. Хранение, транспортировка и обработка образцов в пробирках Roche сверх установленного периода времени в 7 дней приводит к ложным результатам из-за загрязнения высокими уровнями геномной ДНК.
3. В образцах из пробирок с K3EDTA на 14-й день хранения содержится значительно больше высокомолекулярных фрагментов геномной ДНК (из-за лизиса лейкоцитов), по сравнению с образцами, хранящимися в пробирках Streck с клеточным стабилизатором.
4. Пробирка Streck Cell-Free DNA BCT представляется наилучшим вариантом для сохранения вкДНК в образцах крови в условиях длительной задержки между венепункцией и отделением плазмы (> 7 дней).
Список сокращений
ДНК – дезоксирибонуклеиновая кислота
вкДНК – внеклеточная ДНК, cfDNA
цоДНК – циркулирующая опухолевая ДНК, ctDNA
gДНК – геномная ДНК, gDNA
ЭДТА – этилендиаминтетрауксусная кислота
FU – единицы флуоресценции
RBC – эритроциты
WBC – лейкоциты
ПЦР – полимеразная цепная реакция, PCR
ddPCR – цифровая капельная ПЦР
NGS – секвенирование нового поколения
BEAMing – метод, сочетающий эмульсионную цифровую ПЦР и проточную цитометрию
Литература
1. T.P. Copeland, B.L. Franc, High-cost cancer imaging: opportunities for utilization management, J. Canc. Pol. 12 (2017) 16–20.
2. G. Siravegna, et al., Integrating liquid biopsies into the management of cancer, Nat. Rev. Clin. Oncol. 14 (2017) 531.
3. A.R. Thierry, et al., Origins, structures, and functions of circulating DNA in oncology, Cancer Metastasis Rev. 35 (3) (2016) 347–376.
4. H.R. Underhill, et al., Fragment length of circulating tumor DNA, PLoS Genet. 12 (7) (2016), e1006162.
5. S. Jahr, et al., DNA fragments in the blood plasma of cancer patients: quantitations and evidence for their origin from apoptotic and necrotic cells, Cancer Res. 61 (4) (2001) 1659.
6. E. Crowley, et al., Liquid biopsy: monitoring cancer-genetics in the blood, Nat. Rev. Clin. Oncol. 10 (8) (2013) 472–484.
7. A.S. Devonshire, et al., Towards standardisation of cell-free DNA measurement in plasma: controls for extraction efficiency, fragment size bias and quantification, Anal. Bioanal. Chem. 406 (26) (2014) 6499–6512.
8. S. Parpart-Li, et al., The effect of preservative and temperature on the analysis of circulating tumor DNA, Clin. Cancer Res. 23 (10) (2017) 2471–2477.
9. S.E. Norton, et al., A new blood collection device minimizes cellular DNA release during sample storage and shipping when compared to a standard device, J. Clin. Lab. Anal. 27 (4) (2013) 305–311.
10. S.E. Norton, et al., A stabilizing reagent prevents cell-free DNA contamination by cellular DNA in plasma during blood sample storage and shipping as determined by digital PCR, Clin. Biochem. 46 (15) (2013) 1561–1565.
11. Y. Hu, et al., False-Positive Plasma Genotyping Due to Clonal Hematopoiesis, Clinical Cancer Research, 2018.
12. A.L. Young, et al., Clonal haematopoiesis harbouring AML-associated mutations is ubiquitous in healthy adults, Nat. Commun. 7 (2016) 12484.
13. Q. Kang, et al., Comparative analysis of circulating tumor DNA stability in K3EDTA, Streck, and CellSave blood collection tubes, Clin. Biochem. 49 (18) (2016) 1354–1360.
14. P.V. Toro, et al., Comparison of cell stabilizing blood collection tubes for circulating plasma tumor DNA, Clin. Biochem. 48 (15) (2015) 993–998.
15. Roche, Cell Free DNA Collection Tubes, 2018 cited 2018 08/08/18.; Available from: https://sequencing.roche.com/en/products-solutions/by-category/samplecollection/
cell-free-dna-collection-tube.html.
16. R. Dhallan, et al., Methods to increase the percentage of free fetal dna recovered from the maternal circulation, J. Am. Med. Assoc. 291 (9) (2004) 1114–1119.
17. N.J. Panaro, et al., Evaluation of DNA fragment sizing and quantification by the agilent 2100 bioanalyzer, Clin. Chem. 46 (11) (2000) 1851–1853.
18. A.J. Bronkhorst, J. Aucamp, P.J. Pretorius, Cell-free DNA: preanalytical variables, Clin. Chim. Acta 450 (2015) 243–253.
19. M. Jung, et al., Changes in concentration of DNA in serum and plasma during storage of blood samples, Clin. Chem. 49 (6) (2003) 1028.
20. S. Nikolaev, et al., Circulating tumoral DNA: preanalytical validation and quality control in a diagnostic laboratory, Anal. Biochem. 542 (2018) 34–39.
21. C. Alidousty, et al., Comparison of blood collection tubes from three different manufacturers for the collection of cell-free DNA for liquid biopsy mutation testing, J. Mol. Diagn. 19 (5) (2017) 801–804.
22. A.J. Bronkhorst, et al., Characterization of the cell-free DNA released by cultured cancer cells, Biochim. Biophys. Acta 1863 (1) (2016) 157–165.
Основные положения
1. Сравнили две коммерческие пробирки для сбора внеклеточной ДНК: Streck Cell-Free DNA BCT T и Roche Cell Free DNA Collection Tubes.
2. Образцы крови, взятые у здоровых добровольцев в пробирки Streck и Roche, хранились при комнатной температуре в течение 14 дней.
3. Концентрация вкДНК плазмы измерялась в 5 временных точках (День 0, 4, 7, 10 и 14).
4. Загрязнение геномной ДНК определяли с помощью капиллярного электрофореза.
5. Пробирки Streck сохраняли стабильность образца при комнатной температуре в течение 14 дней после сбора, в отличие от пробирок Roche, которые стабилизировали образец только в течение 7 дней.
6. Наилучший вариант контейнера для взятия крови в условиях длительного хранения образцов (> 7 дней) - пробирка Streck Cell-Free DNA BCT.
7. Пробирки Roche подходят для сбора и хранения образцов при комнатной температуре не более 7 дней.
1. Пробирки Streck BCT сохраняли стабильность образца крови в течение 14 дней после сбора, в отличие от пробирок Roche, которые стабилизировали образец только в течение 7 дней. Это согласуется с рекомендациями производителей Streck и Roche, а также с предыдущими исследованиями.
2. Хранение, транспортировка и обработка образцов в пробирках Roche сверх установленного периода времени в 7 дней приводит к ложным результатам из-за загрязнения высокими уровнями геномной ДНК.
3. В образцах из пробирок с K3EDTA на 14-й день хранения содержится значительно больше высокомолекулярных фрагментов геномной ДНК (из-за лизиса лейкоцитов), по сравнению с образцами, хранящимися в пробирках Streck с клеточным стабилизатором.
4. Пробирка Streck Cell-Free DNA BCT представляется наилучшим вариантом для сохранения вкДНК в образцах крови в условиях длительной задержки между венепункцией и отделением плазмы (> 7 дней).
Список сокращений
ДНК – дезоксирибонуклеиновая кислота
вкДНК – внеклеточная ДНК, cfDNA
цоДНК – циркулирующая опухолевая ДНК, ctDNA
gДНК – геномная ДНК, gDNA
ЭДТА – этилендиаминтетрауксусная кислота
FU – единицы флуоресценции
RBC – эритроциты
WBC – лейкоциты
ПЦР – полимеразная цепная реакция, PCR
ddPCR – цифровая капельная ПЦР
NGS – секвенирование нового поколения
BEAMing – метод, сочетающий эмульсионную цифровую ПЦР и проточную цитометрию
Литература
1. T.P. Copeland, B.L. Franc, High-cost cancer imaging: opportunities for utilization management, J. Canc. Pol. 12 (2017) 16–20.
2. G. Siravegna, et al., Integrating liquid biopsies into the management of cancer, Nat. Rev. Clin. Oncol. 14 (2017) 531.
3. A.R. Thierry, et al., Origins, structures, and functions of circulating DNA in oncology, Cancer Metastasis Rev. 35 (3) (2016) 347–376.
4. H.R. Underhill, et al., Fragment length of circulating tumor DNA, PLoS Genet. 12 (7) (2016), e1006162.
5. S. Jahr, et al., DNA fragments in the blood plasma of cancer patients: quantitations and evidence for their origin from apoptotic and necrotic cells, Cancer Res. 61 (4) (2001) 1659.
6. E. Crowley, et al., Liquid biopsy: monitoring cancer-genetics in the blood, Nat. Rev. Clin. Oncol. 10 (8) (2013) 472–484.
7. A.S. Devonshire, et al., Towards standardisation of cell-free DNA measurement in plasma: controls for extraction efficiency, fragment size bias and quantification, Anal. Bioanal. Chem. 406 (26) (2014) 6499–6512.
8. S. Parpart-Li, et al., The effect of preservative and temperature on the analysis of circulating tumor DNA, Clin. Cancer Res. 23 (10) (2017) 2471–2477.
9. S.E. Norton, et al., A new blood collection device minimizes cellular DNA release during sample storage and shipping when compared to a standard device, J. Clin. Lab. Anal. 27 (4) (2013) 305–311.
10. S.E. Norton, et al., A stabilizing reagent prevents cell-free DNA contamination by cellular DNA in plasma during blood sample storage and shipping as determined by digital PCR, Clin. Biochem. 46 (15) (2013) 1561–1565.
11. Y. Hu, et al., False-Positive Plasma Genotyping Due to Clonal Hematopoiesis, Clinical Cancer Research, 2018.
12. A.L. Young, et al., Clonal haematopoiesis harbouring AML-associated mutations is ubiquitous in healthy adults, Nat. Commun. 7 (2016) 12484.
13. Q. Kang, et al., Comparative analysis of circulating tumor DNA stability in K3EDTA, Streck, and CellSave blood collection tubes, Clin. Biochem. 49 (18) (2016) 1354–1360.
14. P.V. Toro, et al., Comparison of cell stabilizing blood collection tubes for circulating plasma tumor DNA, Clin. Biochem. 48 (15) (2015) 993–998.
15. Roche, Cell Free DNA Collection Tubes, 2018 cited 2018 08/08/18.; Available from: https://sequencing.roche.com/en/products-solutions/by-category/samplecollection/
cell-free-dna-collection-tube.html.
16. R. Dhallan, et al., Methods to increase the percentage of free fetal dna recovered from the maternal circulation, J. Am. Med. Assoc. 291 (9) (2004) 1114–1119.
17. N.J. Panaro, et al., Evaluation of DNA fragment sizing and quantification by the agilent 2100 bioanalyzer, Clin. Chem. 46 (11) (2000) 1851–1853.
18. A.J. Bronkhorst, J. Aucamp, P.J. Pretorius, Cell-free DNA: preanalytical variables, Clin. Chim. Acta 450 (2015) 243–253.
19. M. Jung, et al., Changes in concentration of DNA in serum and plasma during storage of blood samples, Clin. Chem. 49 (6) (2003) 1028.
20. S. Nikolaev, et al., Circulating tumoral DNA: preanalytical validation and quality control in a diagnostic laboratory, Anal. Biochem. 542 (2018) 34–39.
21. C. Alidousty, et al., Comparison of blood collection tubes from three different manufacturers for the collection of cell-free DNA for liquid biopsy mutation testing, J. Mol. Diagn. 19 (5) (2017) 801–804.
22. A.J. Bronkhorst, et al., Characterization of the cell-free DNA released by cultured cancer cells, Biochim. Biophys. Acta 1863 (1) (2016) 157–165.
Основные положения
1. Сравнили две коммерческие пробирки для сбора внеклеточной ДНК: Streck Cell-Free DNA BCT T и Roche Cell Free DNA Collection Tubes.
2. Образцы крови, взятые у здоровых добровольцев в пробирки Streck и Roche, хранились при комнатной температуре в течение 14 дней.
3. Концентрация вкДНК плазмы измерялась в 5 временных точках (День 0, 4, 7, 10 и 14).
4. Загрязнение геномной ДНК определяли с помощью капиллярного электрофореза.
5. Пробирки Streck сохраняли стабильность образца при комнатной температуре в течение 14 дней после сбора, в отличие от пробирок Roche, которые стабилизировали образец только в течение 7 дней.
6. Наилучший вариант контейнера для взятия крови в условиях длительного хранения образцов (> 7 дней) - пробирка Streck Cell-Free DNA BCT.
7. Пробирки Roche подходят для сбора и хранения образцов при комнатной температуре не более 7 дней.


